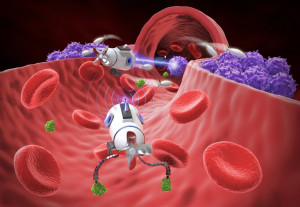
La medicina está al borde de una nueva era, una en la que ejércitos de robots microscópicos navegarán por nuestro torrente sanguíneo para combatir enfermedades a nivel celular. Lejos de ser ciencia ficción, los microbots médicos son una realidad en desarrollo, prometiendo una precisión sin precedentes en el tratamiento de patologías que hoy en día requieren intervenciones sistémicas y agresivas.
¿Qué son exactamente los microbots médicos?
En esencia, los microbots médicos son robots diminutos, con tamaños que varían desde la escala micrométrica hasta unos pocos milímetros, diseñados para realizar tareas específicas dentro del cuerpo humano.
A diferencia de los nanomateriales tradicionales, estos dispositivos son sistemas autónomos y dinámicos, programados para interactuar directamente con el entorno biológico. Su principal ventaja radica en su capacidad para tratar afecciones localizadas, como tumores o coágulos sanguíneos, sin los efectos secundarios devastadores de tratamientos como la quimioterapia, que afectan a todo el cuerpo.
La fabricación de estos dispositivos es un campo de vanguardia que emplea técnicas de microfabricación como los sistemas microelectromecánicos. Los materiales utilizados son tan variados como sus aplicaciones, abarcando desde el silicio y polímeros hasta hidrogeles biocompatibles e incluso adn plegado. La elección del material es crucial, ya que debe ser biocompatible para evitar toxicidad y reacciones adversas en el organismo.
Movilidad de los microbots
Uno de los mayores desafíos en el diseño de microbots es la propulsión y el control dentro de los complejos y fluidos entornos del cuerpo humano. Los investigadores están explorando diversas estrategias, a menudo inspirándose en la propia naturaleza y apoyándose en la inteligencia artificial y el aprendizaje por refuerzo:
- Campos magnéticos: Estos campos no interfieren, aparentemente, con los tejidos corporales ni son bloqueados por ellos, lo que permite una navegación segura y precisa. Pequeñas partículas magnéticas incorporadas en los microbots permiten dirigirlos a través del torrente sanguíneo, incluso contra la corriente.
- Propulsión acústica: Mediante la creación de burbujas de aire en cavidades del robot, las ondas de ultrasonido pueden generar vórtices que impulsan al microbot hacia adelante.
- Inspiración biológica: De manera similar a los flagelos de las bacterias se han desarrollado microrobots que imitan la forma y el movimiento de los glóbulos blancos para desplazarse por la sangre.
Campo de actuación
Las aplicaciones potenciales de los microbots médicos son vastas y revolucionarias, abarcando desde la administración de fármacos hasta la cirugía mínimamente invasiva.
- Administración dirigida de fármacos: esta es quizás la aplicación más investigada. Los microbots pueden transportar fármacos y liberarlos directamente en el lugar de la enfermedad, como un tumor, aumentando la eficacia del tratamiento y minimizando los efectos secundarios en el resto del cuerpo.
- Microcirugía: estos diminutos robots tienen el potencial de realizar procedimientos quirúrgicos con una precisión inalcanzable para la mano humana. Podrían, por ejemplo, reparar tejidos dañados, eliminar coágulos de sangre o incluso romper cálculos renales.
- Diagnóstico y detección: los microbots podrían equiparse con sensores para detectar biomarcadores de enfermedades en fases muy tempranas, permitiendo un diagnóstico más rápido y preciso.
- Regeneración ósea: investigadores están explorando el uso de microbots para transportar materiales que ayuden a reparar fracturas óseas complejas, con el objetivo final de regenerar huesos humanos.
Un ejemplo fascinante es el nanogripper, un robot funcional cuyas “manos” y “dedos” están hechos de ADN plegado, aprovechando su fuerza y flexibilidad para “agarrar” virus específicos e impedir que infecten las células. Otro avance notable son los anthrobots, biobots “cultivados” a partir de tejido pulmonar humano que pueden autoensamblarse y han mostrado potencial en la reparación de heridas.
A pesar del enorme potencial, es crucial mantener una perspectiva realista. La tecnología de los microbots médicos se encuentra en una fase muy temprana de desarrollo. Los principales obstáculos incluyen:
- Costos de fabricación: la producción de estos dispositivos a nanoescala es astronómicamente cara. Por ejemplo, la fabricación de nanopartículas médicas puede costar alrededor de 80.000 dólares por gramo, en comparación con los 50 dólares por gramo del oro.
- Ensayos clínicos y aprobación: el camino desde el laboratorio hasta el paciente es largo y riguroso. Se estima que los microbots médicos tardarán entre 10 y 15 años en superar las estrictas pruebas de seguridad y los ensayos clínicos necesarios para su aprobación.
- Biocompatibilidad y biodegradabilidad: es fundamental garantizar que los microbots puedan ser eliminados del cuerpo de forma segura una vez que han cumplido su función, sin dejar residuos tóxicos.
Patologías concretas con mayor potencial de mejora
Si bien el horizonte temporal es amplio, ciertas áreas de la medicina se perfilan como las grandes beneficiadas de esta nanorrevolución. Las patologías que requieren tratamientos altamente localizados y que actualmente sufren de altas tasas de efectos secundarios son las candidatas ideales:
- Cáncer (tumores sólidos): la oncología es, sin duda, el campo más prometedor. Los microbots podrían navegar hasta tumores específicos, como los de vejiga, pulmón o mama, y liberar altas dosis de quimioterapia directamente sobre las células cancerosas, evitando el daño al resto del cuerpo.
- Enfermedades cardiovasculares (aterosclerosis y trombosis): se están desarrollando microbots capaces de viajar por las arterias para disolver placas de colesterol o eliminar coágulos sanguíneos que causan infartos y accidentes cerebrovasculares. Esta aproximación podría ofrecer una alternativa mucho menos invasiva y más efectiva que procedimientos actuales como la angioplastia o el bypass.
- Enfermedades neurodegenerativas (alzheimer y parkinson): uno de los mayores obstáculos en el tratamiento de estas enfermedades es la barrera hematoencefálica, que protege al cerebro pero también impide la llegada de fármacos. Los microbots están siendo diseñados para poder cruzar esta barrera y administrar medicamentos directamente en las áreas cerebrales afectadas, lo que podría revolucionar el tratamiento de estas condiciones.
- Oftalmología (trombosis retiniana): la delicadeza y precisión de los microbots los hacen ideales para intervenciones en el ojo. Ya se han desarrollado prototipos para la administración dirigida de fármacos en la retina con el fin de destruir coágulos que obstruyen el flujo sanguíneo, una causa común de ceguera.
